Diagnos och behandling
Den rådande metoden för att diagnostisera osteoporos är att mäta benmineraltätheten (BMD = Bone Mineral Density) med densitometri, eller så kallad DXA-teknik (Dual-Energy X-Ray Absorptiometry).
 iStock by Getty Images
iStock by Getty Images
BMD korrelerar med benhållfasthet och kan användas för att förutsäga patientens frakturrisk och utifrån det besluta om lämplig behandling. När BMD minskar ökar frakturrisken exponentiellt. Mätningen kan både ge information om frakturrisken på specifika lokaler och den totala frakturrisken. DXA-mätningar på höften ger dock den mest rättvisande prognosen för framtida höftfrakturer. BMD från lårbenshalsen används ofta som referenspunkt av diagnostiska skäl. Socialstyrelsens riktlinjer rekommenderar att både BMD från proximala femur och ländryggen används i bedömningen av framtida frakturrisk.
En eller flera fragilitetsfrakturer i höften eller ryggkotorna i vuxen ålder tyder också på osteoporos och ska bidra till diagnosen. Eftersom det är en tyst sjukdom, är en fraktur ofta den första kliniska manifestationen av osteoporos. Patienter som har haft en osteoporosfraktur har en exponentiellt högre risk för att drabbas av fler frakturer i framtiden. Det innebär att tidig upptäckt och behandling är mycket viktigt för att bryta ”frakturkarriären”.
TOLKA BMD
BMD börjar avta efter att peak bone mass uppnåtts i ung vuxen ålder och processen påskyndas av menopausen. Lågt BMD uppträder oftast hos postmenopausala kvinnor och män över 50 års ålder, vilket ökar deras risk för osteoporos. BMD anges normalt med ett T-score (eller Z-score), som båda är standardavvikelser från medelvärdet. T-score tas fram genom att jämföra
BMD-värdet med data från en referenspopulation som består av unga, friska vuxna av samma kön.
(Z-score genereras genom att jämföra BMD med data från en referenspopulation som baseras på ålder, kön, vikt och etnicitet, och används normalt för barn).
Om BMD är inom 1 standardavvikelse från medelvärdet i referenspopulationen, det vill säga ett
T-score på eller över -1, definieras den av WHO som normal. Om BMD är 1,0-2,5 standardavvikelser under referenspopulationen, ger det ett T-score på -1,0—2,5, vilket definieras som låg bentäthet (osteopeni) och är ett förstadium till osteoporos. Om standardavvikelsen är på eller under 2,5 av medelvärdet i referenspopulationen motsvarar det ett T-score på -2,5 och definieras som osteoporos. Om en patient har ett T-score på -2,5 eller lägre och har drabbats av en eller flera frakturer, anses osteoporosen vara etablerad, eller manifest.
De diagnostiska kriterierna för T-score tillämpas endast på postmenopausala kvinnor och män över 50. För premenopausala kvinnor, män under 50, samt barn, används i regel istället ett
Z-score, som justeras för etnicitet, ålder, kön och vikt. Ett Z-score på 2,0 definieras antingen som “låg benmineraltäthet för kronologisk ålder” eller “under det förväntade värdet för åldern”, enligt International Society for Clinical Densitometry. Ett Z-score över 2,0 anses vara “inom det normala värdet för åldern”.
FRAX
Även om de här definitionerna är avgörande för att diagnostisera osteoporos, bör de inte vara de enda faktorerna som ligger till grund för beslut om behandling. Förutom en utvärdering av BMD bör en detaljerad patientberättelse, kroppsundersökning, riskfaktorer och slätröntgen av kotpelaren (alternativt VFA) för att diagnostisera frakturer på ryggkotorna, bidra till diagnosen. Den 10-åriga sannolikheten för en fraktur kan också beräknas genom att använda FRAX, ett datorbaserat diagnostiskt verktyg, som kan ge hjälp vid bedömningen av risken för framtida frakturer.
OSTEOPOROSBEHANDLING
Idag får alltför få osteoporospatienter behandling inom ett år efter sin första fraktur, vilket resulterar i enorma samhällsekonomiska kostnader och onödigt mänskligt lidande. Dock har det gjorts stora framsteg inom området de senaste åren och oddsen för att få en tidig diagnos och lyckad osteoporosbehandling har ökat. Nya tekniker för att mäta bentäthet och bedöma frakturrisk har utvecklats, samtidigt som nya behandlingsalternativ kan minska risken för frakturer väsentligt.
Det är sedan länge känt att en fraktur lätt kan leda till ytterligare en fraktur. Med tanke på att Sveriges befolkning åldras innebär det att osteoporos även i fortsättningen kommer att vara ett stort folkhälsoproblem, såvida inte förebyggande åtgärder sätts in. Motion, en näringsrik kost och farmakologisk intervention är avgörande för att bryta mönstret.
MOTION
Motion - framförallt viktbärande träning - ökar muskelstyrkan, stimulerar benformationen, reducerar benresorptionen och förbättrar självförtroendet och koordinationen. Därför är det viktigt att sjukgymnastik är en del av rehabiliteringen efter en fragilitetsfraktur. Regelbunden motion bör också vara en del av förebyggandet och behandlingen av osteoporos på lång sikt. Motsatsen gäller för immobilitet, som bidrar stort till benförlust och om möjligt ska undvikas.
KOST
Ett fullgott kostintag av kalcium, D-vitamin, protein och andra benstärkande näringsämnen är viktigt hela livet för att minimera risken för osteoporos och framtida frakturer. Enligt de Nordiska näringsrekommendationerna behöver kvinnor och män från 18 år och uppåt få i sig minst 800 mg kalcium och 10 μg D-vitamin per dag. För personer över 75 år ligger det dagliga rekommenderade intaget av D-vitamin på 20 μg. Lättillgängligt kalcium finns i mjölk och mejeriprodukter som ost och yogurt, vilka också är rika på protein. D-vitamin genereras framförallt från solen men finns även i vissa livsmedel.
Både kalcium- och D-vitaminbrist är vanligt bland äldre. För de som inte kan tillgodogöra sig tillräckligt med kalcium från kosten och riskerar att få osteoporos, kan ett kalciumtillskott vara indikerat. För patienter som får osteoporosläkemedel, rekommenderas i regel ett kombinationspreparat med 500 mg kalcium och 10-20 μg D-vitamin, för att maximera effektiviteten av den benspecifika terapin. Kalcium- och D-vitamintillskott har också visat sig minska risken för sekundär hyperparatyreoidism och proximal femurfraktur bland institutionaliserade äldre.
FARMAKOLOGISK INTERVENTION
De vanligaste farmakologiska terapierna för osteoporos i Europa är bisfosfonaterna alendronat, risedronat och zoledronsyra, preparat som baseras på paratyreoideahormon och denosumab.
Hormonersättningsbehandling, vilken bromsar postmenopausal bennedbrytning och förebygger benförlust i alla skelettlokaler, användes tidigare flitigt men rekommenderas inte längre för att förebygga frakturer, då riskerna bedöms vara större än nyttan hos yngre menopausala kvinnor. Hormonersättningsbehandling har förknippats med en ökad risk för kranskärlssjukdom, bröstcancer och stroke.
Bisfosfonater, som hämmar benresorptionen genom att hämma osteoklasternas (de bennedbrytande cellernas) aktivitet, är den vanligaste läkemedelsklassen som används vid osteoporosbehandling. Bisfosfonater ska förskrivas tillsammans med kalcium och D-vitamin för äldre patienter som har brist på kalcium eller D-vitamin, eller riskerar att få sådan brist.
HYPOKALCEMI - UTREDNING OCH PROVTAGNING
Hypokalcemi definieras som joniserat serumkalcium under laboratoriets nedre referensgräns, ofta < 1,15 mmol/l eller totalt serumkalcium < 2,15-2.20 mmol/l (efter korrigering för S-albumin). Symtom på hypokalcemi uppstår ofta inte förrän joniserat serumkalcium sjunker till < 1,0 mmol/l.
Snabbt och djupt sjunkande kalcium, exempelvis efter en operation kan ge upphov till svåra symtom snabbare, redan inom 1-2 dagar. Akut hypokalcemi associeras framförallt med ökad neuromuskulär irritabilitet. Däremot kan kliniska fynd vara svåra att urskilja hos svårt sjuka patienter, och personer med njursvikt är ofta asymtomatiska.
DIFFERENTIALDIAGNOSER
- Hypoparatyreoidism
- Malabsorption
- Grav D-vitaminbrist
- Akut njursvikt
- Hereditära former
Provtagning, anamnes (hereditet och operativa ingrepp, exempelvis för primär hyperparatyreoidism eller tyreotoxikos) och klinisk undersökning är vägledande vid utredning av hypokalcemi. Kalciumkoncentrationen kan mätas på flera sätt, men joniserat kalcium har högst specificitet och sensitivitet.
LATENT TETANI KAN PÅVISAS GENOM PROVOKATIONSTEST
TROUSSEAUS TECKEN
Muskelkramper i arm eller ben som utlöses genom tryck på nerver eller genom att strypa blodtillförseln med BT-manschett uppblåst 20 mmHg över systoliskt blodtryck i 3-5 minuter. Trousseaus tecken förekommer även vid alkalos och störningar i S-kalium.
CHVOSTEKS TECKEN
Spasmer i periorala ansiktsmuskulaturen som utlöses av perkussion av facialisnerven framför örat.
Trousseaus tecken ger 6 procent falskt positiva resultat hos friska personer, medan Chvosteks tecken ger 10 procent falskt positiva resultat. Vara sig Trousseaus tecken eller Chvosteks är dock helt specifika för hypokalcemi och kan saknas.
BASUTREDNING
- P/S-kalcium. Två provtagningar, varav minst en för joniserat kalcium
- S-PTH
- P/S-kreatinin
- P/S-fosfat
KOMPLETTERANDE UTREDNING
- S-ALP (eventuellt benspecifik)
- S-25-hydroxi¬vitamin D3 (kalcidiol)
- P/S-magnesium
- Dygnsurin kalcium
- Utredning av den underliggande orsaken till hypokalcemin
- 1,25-dihydroxivitamin D3 (endast vid misstanke om defekt på vitamin D-receptor)
PROVTAGNING OCH TOLKNING AV RESULTATEN
Vid joniserat serumkalcium < 1,15 mmol/l eller totalt serumkalcium < 2,15-2.20 mmol/l S-PTH föreligger hypokalcemi. Resultatet måste dock sättas i relation till PTH och kreatinin, då framförallt S-PTH-nivån är avgörande för diagnosen när njurfunktionen är normal.
FÖRHÖJT PTH
Förhöjt PTH i kombination med låga serumkalciumnivåer tyder på att paratyreoideafunktionen är normal och att hypokalcemin orsakats av sekundär hyperparatyreoidism. Om patienten samtidigt har normal njurfunktion är orsaken oftast långvarigt bristfälligt intag eller upptag av kalcium och/eller D-vitamin. D-vitaminbrist eller D-vitamininsufficiens kan dock föreligga utan medföljande PTH-stegring och därför bör även S-25-hydroxivitamin D3 bestämmas vid utredning av hypokalcemi.
Vid uttalad vitamin D-brist kan patienten förutom förhöjt PTH ha benspecifik ALP-förhöjning,
lågt S-fosfat, skelettpåverkan och tecken på osteomalaci. Misstankar om bristtillstånd eller malabsorption förstärks om kalcium i dygnsurin < 2–3 mmol.
S-PTH kan även vara förhöjt vid kronisk njurinsufficiens, vilket kan orsaka hyperfosfatemi och hypokalcemi. Hos patienter som är nyopererade för pHPT eller tyreotoxikos är det inte ovanligt att PTH ligger förhöjd veckor till månader postoperativt så länge remineraliseringen av skelettet pågår (så kallat ”hungry bone”-syndrom) där hypokalcemi kan vara uttalad.
NORMALT ELLER SÄNKT PTH
Hypokalcemi utan förhöjt PTH indikerar hypoparatyreoidism, det vill säga bristfällig insöndring av PTH från bisköldkörtlarna. Vid hypoparatyreoidism är P/S-fosfat förhöjt eftersom PTH-bristen medför att njurarna minskar fosfatutsöndringen. PTH-nivån kan variera från låg till normal vid partiell hypoparatyreoidism men sjunker under det nedre referensvärdet för metoden vid total hypoparatyreoidism. ALP förblir i regel normalt.
Hypokalcemi med hypoparatyreoidism kan orsakas av medfödda sjukdomar eller förvärvas på grund av tex strålningsbehandling mot halsen eller postoperativt om för mycket paratyreoideavävnad avlägsnats. Postoperativ hypoparatyreoidism är vanligtvis partiell och försvinner inom några veckor eller månader. Om patienten fortfarande behöver substitution av kalcium och/eller vitamin D ett år efter operation anses hypoparatyreoidismen vara kronisk.
I vissa fall uppstår idiopatisk hypoparatyreoidism på grund av autoimmuna processer. PTH är då mycket lågt eller omätbart. PTH-utsöndringen kan också hämmas av medfödd aplasi av paratyreoidea, hypomangesemi och kronisk alkalos, vilket i sin tur kan leda till hypokalcemi.
Vid pseudohypoparatyreoidism är PTH däremot lätt förhöjt eller normalt.
BEHANDLING AV HYPOKALCEMI
Behandling av hypokalcemi varierar beroende på svårighetsgrad och den underliggande orsaken. Akut hypokalcemi kräver sjukhusvård, medan ett kroniskt tillstånd ofta kan behandlas av allmänläkare beroende på orsak. Vid akut hypokalcemi ges kalciumglukonat intravenöst, medan lindrigare fall av kalciumbrist kan behandlas med kalciumtabletter.
Vid misstänkt magnesiumbrist ges även magnesiumsulfat. Patienter med idiopatisk eller postoperativ hypoparatyreoidism behandlas även med vitamin D3. Om den underliggande orsaken till hypokalcemin är kalcium- eller D-vitamininsufficiens ges kombinationspreparat som innehåller både kalciumkarbonat och kolekalciferol.
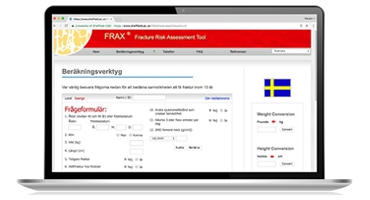
FRAX OCH OSTEOPOROS
FRAX (Fracture Risk Assessment Tool) är ett diagnostiskt verktyg som har utvecklats av WHO som ett komplement till densitometri, för att förbättra bedömningen av frakturrisken hos osteoporospatienter.
Medicinskt granskad av Viatris Staff 02 May 2020


